
Jak działa badanie przesiewowe pod kątem SMA, czyli metoda PCR?
W listopadzie 2020 roku, Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) poinformowała o możliwym rozszerzeniu badań przesiewowych noworodków o SMA. Świetna wiadomość, bo jak wiecie, im prędzej rozpozna się SMA i rozpocznie leczenie, tym większa efektywność terapii!
Metodą, która będzie stosowana w badaniach przesiewowych jest technika PCR (ang. Polymerase chain reaction; reakcja łańcuchowa polimerazy… Brzmi strasznie, ale nie martwcie się, wszystko się za moment rozjaśni). Opracowana w 1983 roku i nagrodzona Nagrodą Nobla 10 lat później, jest jedną z podstawowych technik używanych przez miliony laboratoriów na całym świecie – zarówno akademickich jak i diagnostycznych, czy nawet kryminalistycznych! W ogromnym skrócie, PCR jest metodą, za pomocą której możemy powielić wybrany fragment DNA, w naszym przypadku koralik (ekson) 7 genu SMN1. Na przestrzeni lat PCR został poddany różnym modyfikacjom, ulepszeniom i obecnie jest bardzo zaawansowaną i czułą techniką pozwalającą na naprawdę szczegółową analizę DNA.
Na czym polega PCR?
By zrozumieć na czym polega ta super technika laboratoryjna, musimy się cofnąć o kilka kroków i zrozumieć, jak jest zbudowane nasze DNA. Jak zapewne wiecie, DNA to nic innego jak cała informacja o ludzkiej komórce, wraz ze wszystkimi instrukcjami do działania. Może Was to zaskoczy, ale ten niezwykle długaśny kod genetyczny jest zbudowany tylko z czterech różnych cegiełek (wielokrotnie powtarzających się w różnej kolejności, ale tylko czterech). Są to cztery zasady i będziemy je określać jako T, A, C i G (czyli Tymina, Adenina, Cytozyna i Guanina, ale na ten moment nie musicie tego pamiętać). Ustawione jedna za drugą, trochę tak, jakby „trzymały się za ręce”, te właśnie zasady tworzą nić DNA:

Każda zasada jest tutaj w bardzo dokładnie określonym miejscu. Jeśli któraś z zasad jest przypadkowo ominięta lub zastąpiona inną, taki przypadek nazywamy „mutacją”. Czasem mutacja może dotyczyć tylko jednej zasady, a czasami większego fragmentu DNA – tak jak ma to zwykle miejsce w SMA. Mutacje mogą mieć poważne konsekwencje dla funkcjonowania komórki, ponieważ mogą spowodować duże zmiany w zapisanej dla komórki informacji. Zilustrujmy to tak: jeśli czytacie bardzo ciekawą książkę, ale ktoś wyrwie z niej kilka przypadkowych stron, może być Wam trudno poskładać informacje w całość i możecie ominąć jakiś bardzo ważny dla całej fabuły wątek. Tak samo komórka, która posiada niekompletną informację o tym jak ma funkcjonować, może zacząć funkcjonować niepoprawnie, jak motoneurony w SMA.
PCR to reakcja, którą można wykonać w laboratorium, a w trakcie której naukowcy mogą łączyć ze sobą zasady T, A, C i G w odpowiedniej kolejności, tak, żeby właśnie stworzyć nić DNA. Nie jest to jakiekolwiek, przypadkowe DNA, ale jakiś konkretny fragment, który nas interesuje, w przypadku SMA jest to powielanie eksonu 7 w genie SMN1 w badanej próbce. W odpowiednio dobranych warunkach laboratoryjnych można więc namnożyć wiele, wiele kopii tego samego fragmentu DNA poprzez dodawanie T, A, C i G w odpowiedniej kolejności, dyktowanej przez odpowiedni szablon. Szablonem takim (czy też matrycą) jest oryginalne DNA z komórki ludzkiej. Myślę, że rysunek poniżej może pomóc zrozumieć lepiej, o co tutaj chodzi:

Teraz spróbujmy odnieść tę technikę z powrotem do SMA.
Przypomnijmy sobie co nieco o genetyce SMA. Żeby zrozumieć, jak działa PCR w przypadku diagnozy SMA, musimy przypomnieć sobie najpierw, jaka jest w ogóle przyczyna tej choroby. Jak zapewne pamiętacie, większość przypadków SMA jest spowodowane brakiem, czyli tak zwaną delecją genu SMN1.
Teraz cofnijmy się jeszcze dalej – co to właściwie oznacza, że nie ma genu SMN1? Wszystkie geny w ludzkim organizmie występują w podwójnych kopiach – jedna kopia od mamy jedna kopia od taty. Osoby zdrowe mają dwie, całe, prawidłowe kopie genu SMN1 z wszystkimi koralikami i łańcuszkami, czyli częściami kodującymi i niekodującymi. Znaczna większość osób chorych na SMA nie ma koralika 7 (lub 7 i 8) w obu kopiach genu SMN1 czyli dwa razy brakuje sporej części genu. W praktyce oznacza to, że gen SMN1 staje się bezużyteczny, a w uproszczeniu mówi się, że go po prostu nie ma.
Genetyka SMA ma tutaj bardzo duże znaczenie, ponieważ test PCR zaprojektowany jest tak, żeby sprawdzić czy w danej próbce obecny jest koralik 7, w obu kopiach genu SMN1.
Jak czytaliście kilka akapitów wyżej, reakcja PCR pozwala na powielenie w dużej ilości DNA na podstawie konkretnego szablonu. W przypadku testu SMA szablonem takim jest właśnie koralik 7 SMN1 z pobranego materiału, czyli suchej kropli krwi dziecka. Naukowcy mogą namnożyć tę część za pomocą PCR w dużych ilościach, dosłownie w milionach kopii.
Wyniki:
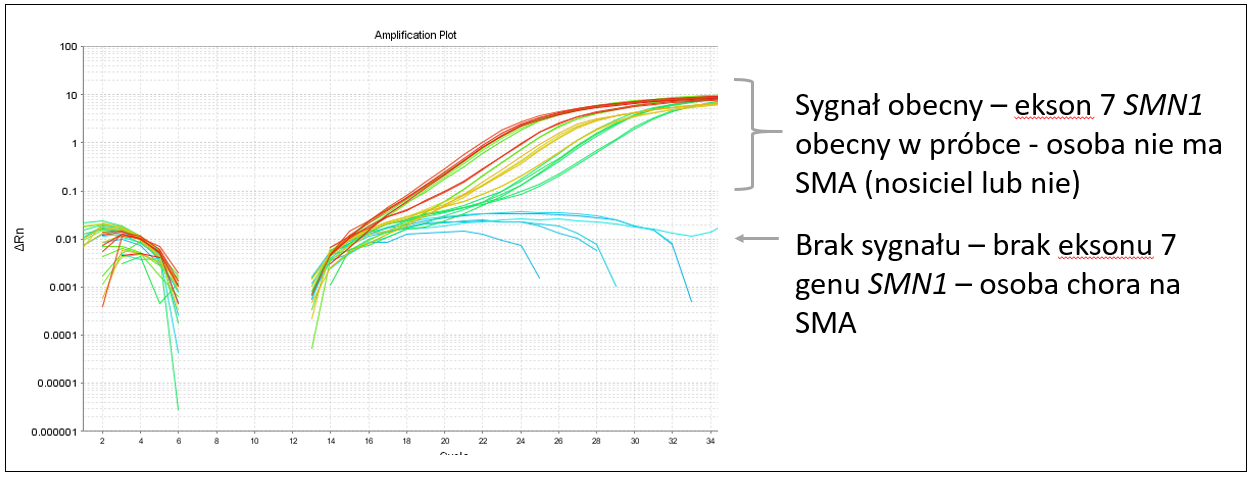
Jeśli ekson (koralik) 7 jest obecny, w teście PCR pojawią się miliony jego kopii, w wyniku czego diagności zaobserwują odpowiedni sygnał w badaniu. To oznacza, że gen SMN1 jest cały i prawidłowy, a białko będzie produkowane – osoba jest zdrowa, test wychodzi negatywny.
Jeśli koralika 7 w genie SMN1 nie ma, nie pojawią się jego powielone kopie, nie będzie więc sygnału, który może być rozpoznany przez diagnostów w laboratorium. Brakuje sporej części genu SMN1, białka więc też nie będzie – osoba jest chora, test wychodzi pozytywny.
Ograniczenia badania
Test PCR jest świetny, tani, i łatwo można go dostosować do konkretnych potrzeb, dlatego używa się go na przykład do wykrywania zakażenia wirusem SARS-CoV-2. W przypadku SMA ten test ma jednak pewne ograniczenia:
- Nie wykrywa mutacji punktowych, a więc nie wykryje SMA u ok. 5% chorych. U około 5% chorych na SMA eksony (koraliki) 7 i 8 genu SMN1 są obecne i w badania PCR zostanie zaobserwowany sygnał. Co więc dzieje się u tych pacjentów? W tych przypadkach choroba spowodowana jest niewielką zmianą w SMN1 (ponownie, mutacją), która całkowicie uniemożliwia komórce odczytanie instrukcji zapisanej w genie SMN1 i przez to nie pozwala na produkcję prawidłowego białka (podobnie jak w przypadku usunięcia koralika 7 i 8 w SMN1). Badanie PCR nie jest w stanie wyłapać tej zmiany i w tym przypadku wynik wychodzi fałszywie negatywny – statystycznie w Polsce będzie to dotyczyć około 2 dzieci rocznie. Czy istnieje technika, które wyłapie małe zmiany? Tak, jest to sekwencjonowanie DNA czyli odczytanie genu SMN1 litera po literze. W ten sposób, porównując litery genu SMN1 osoby diagnozowanej do osoby zdrowej, możemy zauważyć każdą, nawet najmniejszą zmianę.
- Nie odpowiada na pytanie na nosicielstwo – to znaczy, że badanie PCR daje zero jedynkową odpowiedź na pytanie – czy w próbce znajduje się ekson 7 genu SMN1?
- Nie znajduje się – osoba jest chora na SMA, nie ma eksonu 7 ani od mamy, ani od taty.
- Znajduje się – osoba może być albo nosicielem (mieć jedną prawidłową kopię, a drugą nieprawidłową) albo mieć dwie prawidłowe kopie i być zdrowa.
- Nie określa ilości kopii genu SMN1 i SMN2. Na pytanie o ilość kopii genu odpowiada tzw. badanie MLPA. Jeśli test przesiewowy, czyli badanie PCR pod kątem SMA, wyjdzie pozytywny, to wykonuje się badanie MLPA, które:
- potwierdza diagnozę – powinno wykazać 0 kopii SMN1
- określa liczbę kopii SMN2, co może mówić o przewidywanym typie choroby.
Podsumowując:
- Do badania przesiewowego pod kątem SMA używa się metody PCR. Metoda ta polega na powieleniu wybranego fragmentu DNA w badanej próbce.
- W przypadku SMA znaczna większość chorych nie ma eksonu 7 lub eksonu 7 i 8 w genie SMN1, natomiast osoby zdrowe i nosiciele go posiadają.
- W celu wykrycia SMA, pobierana jest próbka od noworodka i powielany ekson 7 genu SMN1.
- Jeśli po przeprowadzeniu badania w próbce można zaobserwować sygnał, oznacza to, że ekson 7 jest obecny, a osoba nie ma SMA (są pewne wyjątki).
- Jeśli po przeprowadzeniu badania w próbce nie ma sygnału, to znaczy, że nie ma w niej eksonu 7 i badana osoba jest chora na SMA.
- Badanie PCR nie wykryje ok. 5% chorych, u których SMA jest spowodowane drobną mutacją, a nie brakiem eksonu 7 (lub 7 i 8).
- Badanie PCR nie jest w stanie odpowiedzieć na pytanie, czy ktoś jest nosicielem wadliwego genu, czy nie.
Ciekawostka – co to ma wspólnego z COVID-19?
I jeszcze ciekawostka związana z aktualną sytuacją epidemiologiczną – ten sam test jest używany w polskich i światowych laboratoriach do diagnozowania zakażenia koronowirusem SARS-CoV-2. Może część z Was już się nawet domyśla, jak to działa. W tym przypadku, w pobranej próbce szukamy materiału genetycznego wirusa SARS-CoV-2. Ten poszukiwany fragment musi być specyficzny tylko dla tego konkretnego gatunku koronowirusa, bo jak pewnie wiecie, istnieją również inne koronowirusy, znane ludzkości od dawna. Dlatego test jest tak zaprojektowany, żeby wyłapać tylko tego konkretnego wirusa. I znowu – jeśli pojawi się sygnał, to znaczy że SARS-CoV-2 był obecny w próbce. A jeśli nie ma sygnału, to osoba nie jest zakażona.
Projektowanie badania PCR jest stosunkowo proste i szybkie, jeśli kod genetyczny szukanego fragmentu jest nam znany. Kod genetyczny SARS-CoV-2 został opublikowany pod koniec stycznia 2020 roku i w bardzo szybkim tempie pojawiły się testy pod jego kątem. To nie jest nic dziwnego, w laboratoriach na całym świecie projektuje się testy PCR codziennie i uczy się tego również studentów, nie jest to żadna tajemnica.
Autorki: Martyna Kosno, Katarzyna Chwalenia, Anna Kordala
mgr Martyna Kosno jest aktualnie doktorantką w dziedzinie biochemii na University of Texas Southwestern Medical Center w Dallas. Przed rozpoczęciem doktoratu, Martyna skończyła farmację na Uniwersytecie Medycznym w Łodzi. Na ostatnim roku studiów wzięła udział w programie naukowym BioLab i realizowała roczny projekt naukowy w Stanach Zjednoczonych, który zaowocował publikacją w Molecular Cell. Po zakończeniu projektu i powrocie do Polski, Martyna zdecydowała się kontynuować swoją przygodę z nauką: otrzymała stypendium Fulbrighta i wróciła do Teksasu, aby rozpocząć studia doktoranckie w laboratorium Michaela Rosena. W swoim projekcie doktoranckim skupia się na zrozumieniu, jakie części białka fuzyjnego wywołującego niezwykle złośliwy nowotwór (o nazwie Nut Carcinoma) są konieczne do wytworzenia wewnątrzkomórkowych struktur bezbłonowych, nazywanych kondensatami. W swoich badaniach Martyna chce też zrozumieć, czy powstanie tych kondensatów jest skorelowane z przeistoczeniem zdrowej komórki w komórkę nowotworową. W wolnym czasie Martyna pisze bloga popularnonaukowego Martyna Scribbles oraz angażuje się w różne przedsięwzięcia związane z szerzeniem nauki i medycyny wśród społeczeństwa. Entuzjastka zdrowego stylu życia i sportu, a szczególnie tenisa, snowboardu i pływania.

mgr Katarzyna Chwalenia – magister biochemii UJ, a obecnie doktorantka Zakładu Pediatrii Uniwersytetu Oksfordzkiego. Od kilku lat bada mechanizmy komórkowe chorób mięśniowych. Zainteresowana molekularnym podłożem DMD i SMA, w szczególności biologią RNA. Zajmuje się komunikowaniem nauki w czytelny sposób. Kasia jest autorką V części genetyki dla SMAków na temat tego, jak działa risdiplam.
mgr Anna Kordala – farmaceutka, doktorantka z dziedziny fizjologii, anatomii i genetyki na Uniwersytecie Oksfordzkim, zainteresowana mechanizmami SMA, badaniami klinicznymi i opowiadaniem o nauce w przystępny sposób. Prowadzi sekcję przybliżającą osiągnięcia naukowe w dziedzinie SMA “Ze świata nauki”.


